Основные направления научно-исследовательской работы
Все научно-исследовательские работы на кафедре выполняются согласно научной тематике: «Разработка патогенетически обоснованных методов диагностики и лечения хирургических заболеваний человека». Номер Госрегистрации: №01.030006. Основными научными направлениями кафедры являются следующие темы:
- Хирургия брюшной аорты и магистральных сосудов, в рамках которой выполняются исследования, направленные на совершенствование методов хирургического и рентгенэоваскулярного лечения критической ишемией нижних конечностей, артериальной гипертензии, аневризм брюшной аорты;
- Хирургическое лечение хронической мозговой недостаточности. Эти исследования направлены на совершенствование методов диагностики и хирургического лечения хронической мозговой недостаточности, развившиеся на фоне патологии артерий брахиоцефального ствола;
- Хирургическое лечение заболеваний грудной клетки, легких и плевры. Эти исследования посвящены разработке и совершенствованию методов диагностики и хирургического лечения острых и хронических заболеваний легких и плевры;
- Гепатобилиарная хирургия. Эти исследования направлены на совершенствование и разработку методов диагностики и лечения портальной гипертензии, желчно-каменной болезни, механической желтухи различной этиологии, острого панкреатита, эхинококковой болезни;
- Абдоминальная хирургия. В рамках этого направления выполняются исследования, посвященные совершенствованию методов хирургического лечения язвенной болезни желудка и 12-ти перстной кишки и ее осложнений, улучшению диагностики и хирургического лечения распространенных форм перитонита, совершенствованию методов коррекции потребностей в пластических материалах и энергетических затрат организма энтеральным путем у хирургических больных в критических состояниях (острый перитонит, острая кишечная непроходимость).
- Миниинвазивная хирургия. В этом направлении выполняются исследования, направленные на разработку и усовершенствования различных эндоскопических, рентгенэндобилиарных и рентгеноэндоваскулярных вмешательств.
За 30-летний период существования кафедры в рамках указанных научных направлений выполнено 21 докторских и 75 кандидатских диссертаций.
Сертификаты:
Тезисы:
- ESR_11-12_2016
- Heart Failure 2017 Paris Abstracts
- SISSO 2017
- РНЦЭМП 2017
- РСЦХ им Вахидова 2017
- Сборник тезисов НХК 2017
- Сочи 2017-ангиология и сосудистая хирургия тезис
- 2_13186374232440920
- 2_5222103254619389974
- 10.5923.j.ajmms.20160606.02
- 10.5923.j.ajmms.20170703.02
- 837-2377-1-PB (1)
- Article AJMMS
- ELSA Visionary Summit 2017_Abstracts
- ELSA Visionary Summit 2017_Lecture Note
Статьи:
- Вестник ЭМ-2015-4-2
- Вестник
- Журнал Назария ва клиник тиббиёт 2016 — № 6
- Каримов 2
- Каримов
- Меджурлан 2017 № 3
- Сканированный вариант статьи
- теоритическая и клиническая медецина
- ТТА вестник
- УЗБ № 4 клиппирование язвы ГЭА
- Узб. тиб жур 2016 -1
- Узб. тиб. жур -6 -2015
- Хирургия Узбекистана 2-2017
- 2_165530908625993885
- 4-2017
- 10. Вестник экстренной медицины
- 0866_0 (1)
- 2016 йил. 4 сон Вестник
- Abdullaev1352015BJMMR23484 (1)
- Cтатья 2
- Untitled.FR11
- Вестник 2017, XI (3)
- Вестник ЭМ-2015-4-1
Докторские диссертации, выполненные на кафедре
- Каримов Ш.И. Клиника, диагностика и хирургическое лечение хронических окклюзий брюшной аорты и ее ветвей, 1981. Диссертация выполнена под руководством академиков Покровского А.В., Арипова У.А.
- Аталиев А. Е. Пути улучшения результатов хирургического лечения осложненной дуоденальной язвы у лиц пожилого и старческого возраста, 1989. (Каримов Ш.И.).
- Бабаджанов Б.Д. Кишечно-печеночная недостаточность при остром разлитом перитоните и пути ее коррекции, 1990. (Каримов Ш.И.).
- Назиров Ф.Н. Обоснование выбора способа хирургического лечения язвенной болезни двенадцатиперстной кишки, 1991. (Каримов Ш.И.).
- Ахмедов Р.М. Эндобилиарные вмешательства в диагностике и лечении больных механической желтухой, 1992. (Каримов Ш.И.).
- Нишанов Х.Т. Совершенствование методов диагностики и хирургического лечения эхинококкоза печени, 1992. (Каримов Ш.И., Карелин А.А.).
- Кротов Н.Ф. Пути совершенствования диагностики и лечения гнойно-деструктивных заболеваний легких, 1992. (Каримов Ш.И.).
- Асадов Д.А. Организационные, медицинские и социальные аспекты снижения материнской смертности в регионе высокой рождаемости, 1993. (Каримов Ш.И., Степанянц Р.И.).
- Асраров А.А. Хирургические и эндоваскулярные методы профилактики и лечения гнойно-септических осложнений и полиорганной недостаточности у больных разлитым гнойным перитонитом, 1994. (Каримов Ш.И.).
- Ещанов А.Т. Иммунологические аспекты в диагностике и лечении больных с гидатидным эхинококкозом в экологически неблагоприятной зоне, 1995. (Хаитов Р.М., Каримов Ш.И.).
- Рубин Б.Л. Медико-социальные аспекты семейно-брачных отношений и планирования семьи в Узбекистане, 1995. (Каримов Ш.И., Асадов Д.А.).
- Мадалиев И.Н. Диагностика и тактика хирургического лечения эхинококкоза печени, 1995. (Каримов Ш.И.).
- Эргашев У.Ю. Роль и место нарушений ретикулоэндотелиальной системы при острых разлитых перитонитах и разработка путей их коррекции, 1998. (Каримов Ш.И.).
- Ким В.Л. Малоинвазивные методы в лечении желчно-каменной болезни и ее осложнений, 2002. (Каримов Ш.И.).
- Мирзаев Б.Б. Факторы риска и их влияние на непосредственные результаты хирургического лечения неосложненных аневризм брюшной аорты, 2002. (Каримов Ш.И.).
- Исламов М.С. Патогенетическое обоснование и разработка оригинальных щадящих подходов в лечении диабетической гангрены нижних конечностей, 2002. (Каримов Ш.И.).
- Тешаев О.Р. Разработка критериев и оценка эффективности фазового подхода в лечении воспалительного процесса при острых распространенных перитонитах, 2002. (Бабаджанов Б.Д.).
- Боровский С.П. Рентгенэндоваскулярные вмешательства в профилактике и лечении пищеводных кровотечений у больных с портальной гипертензией, 2003. (Каримов Ш.И.).
- Охунов А.О. Острые гнойно-деструктивные заболевания легких и нереспираторная их деятельность. Проблемы и пути их решения, 2004. (Бабаджанов Б.Д.).
- Бралов А.З. Роль малоинвазивной хирургии с применением фетальной трансплантации в комплексном лечении хронических диффузных поражений печени, 2005. (Доскалиев Ж.А., Каримов Ш.И.).
- Хакимов М.Ш. Пути улучшения диагностики и лечения острого панкреатита, 2006. (Каримов Ш.И.).
- Эгамов Н.Э. Эндобилиарные и эндоваскулярные вмешательства в диагностике и лечении периампулярных опухолей, 2009. (Каримов Ш.И.).
Кандидатские диссертации, выполненные на кафедре
- Кротов Н.Ф. Функционально-морфологические состояние желудка при различных вариантах хронического нарушения висцерального кровообращения, 1984. (Каримов Ш.И., Байбекова Э.М.).
- Каюмов Т.Х. Изменение метаболизма лекарственных веществ в печени в послеоперационном периоде, 1984. (Нажмутдинов К.Н., Каримов Ш.И.).
- Асраров А.А. Совершенствование путей патогенетического лечения разлитого гнойного перитонита, 1986. (Каримов Ш.И.).
- Бекетов Г. Функционально-морфологическая характеристика поджелудочной железы при различных вариантах хронического нарушения висцерального кровообращения, 1986. (Каримов Ш.И., Байбекова Э.М.).
- Риад Нур-Мухаммад Абдуль-Раззак. Оценка противоишемической защиты почек гутимином в хирургии хронических высоких окклюзий брюшной аорты, 1986. (Каримов Ш.И., Пригожин Е.А.).
- Магамадов У.А. Оценка нарушений почечной гемодинамики в хирургии синдрома Лериша и вазоренальной гипертензии, 1987. (Каримов Ш.И., Волынский Ю.Д.).
- Кушмуродов Е.Х. Клиническое и иммунологическое обоснование нового подхода к лечению больных облитерирующим эндоартериитом Т-активином и оценка его эффективности, 1987. (Каримов Ш.И., Гариб Ф.Ю.).
- Ахтаев А.Р. Эндоваскулярная хирургия в комплексном лечении профузных пищеводных кровотечений у больных с портальной гипертензией, 1987. (Каримов Ш.И.).
- Моминов А.Т. Сравнительная оценка эффективности спленэктомии и рентгенэндоваскулярной хирургии в лечении портальной гипертензии, 1987. (Каримов Ш.И., Алтыбаев У.А.).
- Ахмедов Р.М. Фармакометаболизирующая функция печени при перитоните у больных пожилого и старческого возраста, 1987. (Каримов Ш.И., Нажмутдинов К.Н.).
- Мирахмедов А.У. Оценка функционального состояния у больных печени с портальной гипертензией после рентгеноэндоваскулярных вмешательств по данным ближайших и отдаленных результатов, 1988. (Каримов Ш.И.).
- Ким В.Ф. Эндоваскулярная диагностика и транскатетерная хирургия портальной гипертензии, 1988. (Каримов Ш.И.).
- Махбубур Рахман. Длительная внутриартериальная катетерная терапия в комплексном лечении хронической тяжелой ишемии нижних конечностей, 1988 (Каримов Ш.И.).
- Ким В.Л. Возможности чрескожных чреспеченочных эндобилиарных вмешательств при механической желтухе, 1989. (Каримов Ш.И.).
- Исламов М.С. Сравнительная оценка эффективности целенаправленной антибактериальной терапии при различных путях введения антибиотиков у больных разлитым перитонитом, 1989. (Каримов Ш.И.)
- Мирахмедов М.М. Сравнительная оценка и совершенствование существующих оперативных доступов к брюшному отделу аорты и ее ветвям, 1989. (Каримов Ш.И., Мирзамухамедов А.Г.).
- Осипов Н.Г. Оценка эффективности рентгеноэндоваскулярной дилатации в реконструктивной хирургии магистральных артерий нижних конечностей, 1990. (Каримов Ш.И., Зингерман Л.С.).
- Ганиев А.М. Интраоперационная дилатация с малыми реконструктивными вмешательствами при тяжелой ишемии нижних конечностей у больных группы риска, 1990. (Каримов Ш.И.).
- Юнусов И.Р. Эндоваскулярная хирургия и обоснование иммунокоррекции у больных циррозом печени, осложненным портальной гипертензией, 1990. (Каримов Ш.И.).
- Винстон Эмилио Ребело Росеро. Роль лечебного плазмафареза в комплексном лечении разлитого гнойного перитонита, 1990. (Аваков В.Е., Каримов Ш.И.).
- Эргашев У.Ю. Влияние эндобилиарных вмешательств у больных механической желтухой на функциональное состояние печени, 1990. (Каримов Ш.И.).
- Рузметов У.А. Оценка эффективности нового местного гемостатика «гемоцел» при острых травмах и заболеваниях печени, 1990. (Каримов Ш.И., Байбекова Э.М.).
- Дурманов Б.Д. Совершенствование методов ранней диагностики и лечения острой кишечной недостаточности при разлитом перитоните, 1990. (Каримов Ш.И.).
- Ганиев Ш.А. Клинико-фармакологическое обоснование применения индуктора бензонала в предоперационной подготовке больных с хроническими нагноительными заболеваниями легких, 1990. (Нажмутдинов К.Н., Каримов Ш.И.).
- Шоумаров З.Ф. Длительная инфузия в бронхиальную артерию в комплексном лечении больных с острыми гнойно-деструктивными заболеваниями легких, 1991. (Каримов Ш.И.).
- Турдиниязова К.Б. Динамика структурно-функциональных изменений в печени при портальной гипертензии до и после рентгеноэндоваскулярных вмешательств, 1991. (Каримов Ш.И.).
- Арора Анил Кумар. Гемодинамические эффекты гемосорбции у больных с разлитым перитонитом и их коррекция в послеоперационном периоде, 1991. (Аваков В.Е., Каримов Ш.И.).
- Бадшахзар Абдулло. Выбор и оценка оптимального оперативного доступа при хирургическом лечении труднодоступных локализаций эхинококкоза печени, 1991. (Каримов Ш.И.).
- Рашид Первейс. Совершенствование диагностики и лечения инфекции желчных путей при механической желтухе, 1991. (Каримов Ш.И.).
- Ешметов Ф.Ф. Кислородный режим тканей при комплексном хирургическом лечении критической ишемии нижних конечностей, 1992. (Каримов Ш.И., Адылова Ф.Т.).
- Исмаилов А.С. Совершенствование методов дренирования и местного лечения острых абсцессов легких, 1992. (Каримов Ш.И.).
- Ким И.А. Место и возможности длительной внутриартериальной и внутрипортальной катетерной терапии в комплексном лечении острых разлитых перитонитов, 1992. (Каримов Ш.И.).
- Инаятулла Сабер. Оптимизация тактики эндоваскулярной хирургии цирроза печени, 1993. (Каримов Ш.И.).
- Эгамов Н.Э. Диагностика и лечение легочных кровотечений, 1993. (Каримов Ш.И.).
- Тошев Х.Р. Криоксеногепатосорбция в комплексной терапии синдрома эндогенной интоксикации у хирургических больных, 1993. (Каримов Ш.И., Аваков В.Е.).
- Имамов А.А. Оценка функционального состояния печени у больных с гангреной конечности и динамика его изменения под влиянием длительной внутриартериальной катетерной терапии, 1993. (Каримов Ш.И.).
- Боровский С.П. Профилактика и лечения осложнений чрескожных и эндобилиарных вмешательств у больных с портальной гипертензией и механической желтухой, 1994. (Каримов Ш.И.).
- Охунов А.О. Характеристика метаболических изменений при резекции легких и поиск путей их коррекции, 1994. (Бабаджанов Б.Д.).
- Омонов М.П. Роль и место энтеральной детоксикации в комплексном лечении острых разлитых перитонитов, 1994. (Каримов Ш.И.).
- Тешаев О.Р. Оценка эффективности различных методов перитонеальной санации у больных острым разлитым перитонитом, 1994. (Каримов Ш.И.).
- Жуманиязов Д.Ф. Разработка методов ранней диагностики, лечения и профилактики острой почечной недостаточности при разлитом перитоните, 1994. (Каримов Ш.И.).
- Саидов С.С. Ксеноперфузия свиной селезенки в комплексной терапии иммунодефицитных состояний в хирургии, 1995. (Каримов Ш.И., Аваков В.Е.).
- Бабаханов О.А. Некоторые аспекты хирургической коррекции пилородуоденальных язвенных стенозов, 1995. (Назиров Ф.Н.).
- Худайбергенов Б.Т. Разработка и характеристика новых методов санации брюшной полости при местных и диффузных перитонитах, 1996. (Каримов Ш.И.).
- Сафоев Б.Б. Усовершенствование методов лечения больных с острым разлитым перитонитом, 1996. (Асраров А.А.).
- Жанабаев Б.Б. Усовершенствование местных методов хирургического лечения при гнойно-некротических поражениях диабетической стопы, 1997. (Каримов Ш.И.).
- Камалов Т.Т. Эффективность длительной внутриартериальной катетерной терапии в лечении гнойно-некротических поражений стопы при сахарном диабете, 1997. (Кротов Н.Ф.).
- Ишанходжаев Х.Р. Роль и место пункционно-дренажного метода и санации электролизным водным раствором гипохлорита натрия в хирургическом лечении полостных образований печени, 1998. (Нишанов Х.Т.).
- Бекмурадов К. Разработка новых патогенетически обоснованных подходов для усовершенствования лечения гастро-дуоденальных перитонитов, 1998. (Бабаджанов Б.Д.).
- Расулов А.Э. Разработка видеоторакоскопических оперативных вмешательств при эхинококкозе легких, 1999. (Кротов Н.Ф.).
- Хакимов М.Ш. Разработка методов интраоперационной профилактики раневой инфекции с использованием электролизных водных растворов гипохлорита натрия, 2000. (Нишанов Х.Т.).
- Суннатов Р.Д. Обоснование и выбор метода рентгеноэндоваскулярных вмешательств у больных артериальной гипертензией надпочечникового генеза, 2000. (Турсунов Б.З.).
- Умаров Д.М. Состояние липидного обмена и функциональная активность тромбоцитов у больных облитерирующим атеросклерозом и их медикаментозная коррекция на этапах хирургического лечения, 2000. (Турсунов Б.З., Абдуллаходжаева Д.Г.).
- Газиев А.Х. Сравнительная оценка заживления послеоперационной раны у больных после грыжесечений в стационарных и амбулаторных условиях и их реабилитация, 2000. (Асраров А.А.).
- Хаджиев М.Х. Сравнительная характеристика различных методов санации острой эмпиемы плевры, 2000. (Кротов Н.Ф.).
- Норов А.Ж. Электрохимическая антисептика зоны операционного действия и шовного материала в абдоминальной хирургии, 2000. (Нишанов Х.Т.).
- Беркинов У.Б. Лапароскопическая холецистэктомия как метод выбора лечения хронического калькулезного холецистита, 2000. (Каримов Ш.И.).
- Атаханов А. Эпидемиология, особенности клинического течения и хирургического лечения язвенной болезни у подростков и юношей, 2000. (Каримов Ш.И.).
- Мамаражабов С. Совершенствование хирургической тактики сочетанного эхинококкоза легких и печени, 2001. (Кротов Н.Ф.).
- Касымов Д.А. Возможности лапароскопической холецистэктомии при остром холецистите, 2001. (Кротов Н.Ф.).
- Бабабеков А.Р. Совершенствование методов лечения диабетической гангрены нижних конечностей (по данным отдаленных результатов), 2002. (Каримов Ш.И.).
- Юнусметов Ш.А. Сравнительная оценка и совершенствование современных методов хирургического лечения холедохолитиаза, осложненного механической желтухой, 2003. (Каримов Ш.И.).
- Атаханов Д.А. Оптимизация выбора чреспеченочного доступа к воротной вене для выполнения эндоваскулярных вмешательств у больных с портальной гипертензией, 2004. (Каримов Ш.И.).
- Абилов К.У. Трансплантация фетальных гепатоцитов и эндоваскулярные вмешательства в профилактике кровотечений из пищеводно-желудочных флебэктазий у больных циррозом печени, 2005. (Доскалиев Ж.А., Каримов Ш.И., Хамзабаев Ж.Х.).
- Орзиматов С.К. Роль и место декомпрессии кишечника и энтерального зондового питания в комплексном лечении больных острой кишечной непроходимостью, 2005. (Каримов Ш.И.).
- Холматов Ш.Т. Роль и место холецистостомии в лечении острого обтурационного холецистита у больных с высоким операционным риском, 2005. (Боровский С.П.).
- Зокирхонов Ш.Д. Хирургическое лечение больных с гангреной нижних конечностей на фоне длительной внутриартериальной катетерной терапии, 2006. (Каримов Ш.И.).
- Янгибаев А.З. Новые миниинвазивные билиодигестивные анастомозы, 2006. (Каримов Ш.И.).
- Алимухамедова Д.К. Роль и место лучевых методов диагностики в оценке отдаленных результатов лечения желчнокаменной болезни не- и малоинвазивными методами, 2006. (Ким В.Л.).
- Ирназаров А.А. Роль и место чрескожной электронейростимуляции при окклюзирующих поражениях артерий нижних конечностей, 2008. (Каримов Ш.И.).
- Ганиев Д.А. Роль и место торакоскопической симпатэктомии при дистальных поражениях артерий конечностей, 2008. (Каримов Ш.И.).
- Халиков С.П. Выбор хирургической тактики лечения спонтанного пневмоторакса, 2008. (Кротов Н.Ф.).
- Сохибоев Д.П. Совершенствование методов диагностики, хирургического и рентгеноэндоваскулярного лечения вазоренальной гипертензии, 2009. (Турсунов Б.З.).
- Каримов М.Р. Синдром функциональной кишечной недостаточности у больных острой механической кишечной непроходимостью и пути ее коррекции, 2009. (Асраров А.А.).
- Темиров С.Н. Сравнительная оценка результатов адреналэктомии и рентгенэндоваскулярных вмешательств у больных артериальной гипертензией, 2009. (Каримов Ш.И.).
Выполняемые на кафедре научно-исследовательские работы
Докторские диссертации:
- Суннатов Р.Д. Оптимизация диагностики, хирургического и рентгенхирургического лечения различных форм артериальной гипертензии (Каримов Ш.И.).
- Беркинов У.Б. Разработка и совершенствование видеоторакоскопических вмешательств (Каримов Ш.И.).
- Мамараджабов С. Профилактика и пути улучшения результатов лечения эхинококкоза органов грудной и брюшной полости (Каримов Ш.И.).
- Ирназаров А.А. Совершенствование методов диагностики и хирургического лечения больных хронической сосудисто-мозговой недостаточностью (Каримов Ш.И.).
Кандидатские диссертации:
- Келдиеров Б.К. Совершенствование диагностики и хирургического лечения окклюзионных заболеваний брахиоцефальных артерий у больных перенесших ишемический инсульт (Турсунов Б.З.).
- Рихсиев И.Т. Выбор метода ликвидации остаточной полости кисты при видеоторакоскопической эхинококкэктомии легкого (Кротов Н.Ф.).
- Рахманов С.У. Оптимизация технических аспектов чреспеченочных эндобилиарных вмешательств (Боровский С.П.).
- Асраров У.А. Совершенствование методов диагностики и тактики хирургического лечения мультифокального атеросклероза (Каримов Ш.И.).
- Асатуллаев Ж.Р. Клинико-экспериментальное обоснование применения аутогемомассы для ликвидации остаточных полостей печени (Хакимов М.Ш.).
- Давлатов У.Х. Электролизный водный раствор гипохлорита натрия в лечении инфицированного панкреонекроза (Хакимов М.Ш.).
- Маткулиев У. Роль длительной внутрипортальной катетерной терапии в комплексном эндоваскулярном лечении больных с портальной гипертензией (Каримов Ш.И.).
- Адылходжаев А.А. Совершенствование эндоваскулярных вмешательств при заболеваниях поджелудочной железы (Каримов Ш.И.).
- Ахматов О.М. Динамика неврологических симптомов после реконструктивных операций при патологической деформации сонных артерий (Асадуллаев М.М., Каримов Ш.И.).
- Юлбарисов А.А. Возможности дуплексного исследования в выборе операции у больных с хроническими нарушениями мозгового кровообращения (Каримов Ш.И.).
Основные приоритетные научные достижения и разработки кафедры
За 30-летний период существования кафедры на клинической базе выполнены различные научные исследования, результаты которых нашли широкое применение в клинической практике.
Научные разработки в лечении перитонита.
Одним из основных моментов в лечении перитонита была предложенная методика дренирования брюшной полости. Поскольку существующие методы дренирования брюшной полости не позволяют проводить длительный диализ из-за закупорки дренажа оттока фибрином или отграничения их спаечным процессом в брюшной полости, нами разработан метод дренирования, с помощью которого равномерно промываются все отделы брюшной полости (АС на изобретение № 1174031).
Суть заключается в следующем: во время операции через контрапертуру в левом подреберье по передней подмышечной линии в брюшную полость проводят один конец двухпросветной силиконой трубки с множеством боковых отверстий и направляют ее к правому подреберью. Дренажную трубку последовательно проводят над левым углом поперечной ободочной кишки, далее на тело желудка, передней поверхности левой доли печени и через окно в серповидной связке печени, затем по передней поверхности правой доли печени, заднебоковому печеночно-диафрагмальному промежутку в правом подреберье по переднеаксилярной линии. Дренаж располагают таким образом, чтобы боковые оверстия одного просвета находились у круглой связки печени, а второго – равномерно по ходу трубки в брюшной полости. Двухпросветные дренажи оттока проводят через подвздошные области и укладываются последовательно: справа – вдоль подвздошной ямки, латерального канала, в малый таз, слева – в латеральном канале и далее над входом в малый таз.
В качестве дренажей притока, основываясь на законе гидродинамики, после предварительных стендовых опытов с подсчетом, а также эксперимента посредством гидродинамических устройств, нами подобраны оптимальные диаметры перфорационных отверстий. Практическая величина отверстий возрастала в дистальном направлении при диаметре трубки 5,0 мм отверстия были 0,4 мм; 0,6 мм; 0,8 мм; 1,0 и 1,2 мм, что дало возможность равномерно орошать брюшную полость через все отверстия (заявка на изобретение № 3670252/13 «Катетер для перитонеального диализа» с приоритетом от 16.12.83.).
Перитонеальный диализ осуществляли в положении больного полусидя. Диализирующую жидкость подавали в оба конца дренажей притока. В течение 2 суток перитонеальный диализ производили в проточном режиме, а с 3-х суток в фракционном режиме.
Продолжительность перитонеального диализа зависела от общего состояния больного, характера течения заболевания в послеоперационном периоде. Адекватность проводимого диализа оценивалась по отсутствию дефицита жидкости. Предварительное введение 0,25% раствора новокаина по 200 мл в оба конца дренажа притока давало обезболивающий эффект. Во время перитонеального диализа пациентов переводили в положение Фаулера. Это способствовало медленному стоку жидкости в нижние отделы брюшной полости и вытеканию по дренажам оттока. Выход диализата из брюшной полости по дренажам оттока обычно начинается после введения 1,0-1,2 литров жидкости.
При разработке комплекса лечебных мероприятий для выяснения роли декомпресии ЖКТ на фоне перитонеального диализа производилась трансназальная интубация тонкой кишки двухканалными силиконовыми зондами. Этот зонд позволял проводить декомпрессию желудка и тонкой кишки. Для эвакуации содержимого толстой кишки дополнительно выполнялась трансанальная интубация одноканальной трубкой, введенной до селезеночного, а в некоторых случаях – до печеночного угла толстой кишки.
Для использования зонда в режиме кишечного лаважа и энтерального зондового питания на основании объективной оценки переваривающей и всасывательной функции тонкой кишки нами был разработан полифункциональный желудочно-кишечный зонд специальной конструкции (АС на изобретение № 1181669).
В лечении острого перитонита важное значение придавали выбору метода антибактериальной терапии. В зависимости от уровня источника перитонита (начиная от желудка до толстого кишечника) был изучен характер аэробной и анаэробной флоры. Было показано, что со снижением «уровня» источника перитонита увеличивалось соотношение анаэробных бактерий к аэробной микрофлоре. Это легло в основу выбора целенаправленной антибактериальной терапии при разлиом гнойном перитоните. В проведенных исследованиях была доказана эффективность проведения длительной внутриартериальной и внутрипортальной катетерной терапии при разлитом перитоните, особенно в терминальной его стадии.
Научные разработки в лечении портальной гипертензии.
На протяжении всей истории существования нашей кафедры ее сотрудники занимаются интенсивным поиском новых и более эффективных способов лечения цирроза печени и портальной гипертензии – довольно распространенной в нашем регионе тяжелой патологии. При этом улучшение результатов профилактики и лечения кровотечений из варикозных вен пищевода и желудка – основного и наиболее грозного осложнения у данной категории больных, связываются нами с разработкой и применением малоинвазивных технологий, а именно с патогенетически обоснованных методов эндоваскулярной коррекции нарушений воротно-печеночного кровообращения.
Так, проведенные нами научные исследования показали, что по мере прогрессирования портальной гипертензии происходят значительные изменения ангиоархитектоники воротно-печеночного кровообращения. При этом отмечается не только увеличение общей суммы диаметров артерий чревного ствола, что отражает характерное для данной патологии явление спланхнической вазодилатации и свидетельствует о возрастании притока в портальное русло, поддерживающего высокий уровень портальной гипертензии, но и происходит значительное перераспределение потока крови в область селезенки и ослабление артериального кровоснабжения печени. Также отмечается расширение левой желудочной вены – одного из наиболее важных коллекторов ретроградного заполнения варикозных вен пищевода и желудка, в кровоснабжении которых участвуют одновременно и короткие желудочные вены. Формирование гастроэзофагеального или других путей обширного шунтирования крови из воротной вены не только представляет угрозу развития кровотечений, но и резко снижает кровоснабжение печени, способствует снижению ее функции и атрофии органа.
Анализ результатов ангиографических и тензиометрических исследований дает нам основание считать, что для улучшения результатов профилактики и лечения кровотечений из варикозных вен пищевода и желудка при портальной гипертензии эндоваскулярные вмешательства должны быть направлены на основные звенья патогенеза данной патологии и, прежде всего, включать мероприятия для:
— снижения давления в воротной вене, улучшения артериального кровоснабжения печени, что достигается в предлагаемом нами комплексе эмболизацией селезеночной артерии и других артерий чревного ствола.
— блокирования гастроэзофагеальных шунтов путем чрескожной чреспеченочной эмболизации основных венозных коллекторов, питающих ВРВ пищевода и желудка с восстановлением гепатопетального кровотока.
— лечения печеночной недостаточности посредством внутрипортальной инфузии лекарственных средств.
Так, хроническая эмболизация селезеночной артерии металлическими спиралями по разработанной нами методике приводит к снижению портального давления в среднем на 56,4 мм.вод.ст.
Проведенное изучение отдаленных результатов эмболизации селезеночной артерии показало, что редукция притока крови к селезенке сопровождается уменьшением размеров органа, улучшением клеточного состава периферической крови (купирование явлений гиперспленизма), расширением артерий печени и улучшением ее кровоснабжения (гепатоартериализующий эффект), что благоприятно отражалось на ее функциональных возможностях. В то же время, к трехмесячному сроку наблюдения отмечалось возникновение различных артериальных коллатералей к селезенке: чаще перетоки формировались через левую желудочную артерию, желудочно-сальниковую артерию, что требует проведения повторных эндоваскулярных вмешательств для закрепления достигнутого эффекта.
При формировании варикозных вен пищевода и желудка эндоваскулярные вмешательства на артериальной системе должны быть дополнены непосредственной эмболизацией потенциальных источников кровотечения.
Проведенные исследования обнаружили, что в отдаленные сроки после чреспеченочной эмболизации варикозных вен пищевода и кардии отмечается положительная тенденция перехода гепатофугального кровотока, происходит формирование менее опасных путей портокавального шунтирования: через нижнюю брыжеечную вену, спленоренальные шунты, пупочную вену. Вместе с тем в ряде случаев наступала реканализация ранее эмболизированных варикозных вен либо формирование дополнительных путей их кровоснабжения, что представляло реальную угрозу возникновения кровотечения. В этой связи, в сроки 3-4 мес. мы считаем обязательным повторное обследование пациентов, выполнение контрольных ангиографических исследований и при необходимости осуществление реэмболизации указанных сосудов.
При развитии кровотечений из варикозных вен пищевода и желудка чреспеченочная эндоваскулярная окклюзия кровоточащих сосудов должна проводится после временной остановки кровотечения применением зонда-обтуратора Блекмора, вазоконстрикторной, гемостатической терапии, противошоковых мероприятий, коррекции нарушений гомеостаза.
При этом чрескожная чреспеченочная эмболизация варикозных вен пищевода и желудка, прерывание гастроэзофагеального пути оттока крови из портальной системы, как правило, сопровождается повышением портального давления в среднем на 89,6 мм.вод.ст.
Поэтому мы считаем необходимым сочетать облитерацию варикозных вен пищевода и желудка с эмболизацией селезеночной артерии. Снижение притока крови в воротную вену при этом позволяет уменьшить прирост портального давления.
Включение в комплекс эндоваскулярных вмешательств внутрипортальной инфузионной терапии позволяет более эффективно осуществлять профилактику и лечение прогрессирующей печеночной недостаточности в постэмболизационном периоде, значительно быстрее восстанавливать основные функциональные показатели печени, производить контроль состояния эмболизированных сосудов.
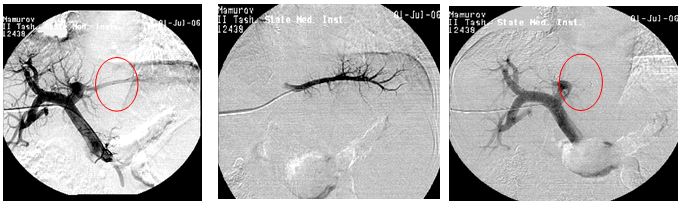
Рис. 42. Чреспеченочная флебография левой желудочной вены при кровотечении из варикозных
вен пищевода и портография после их эмболизации.
Затем в отдаленном периоде необходимо производить поэтапную эмболизацию реканализированных и вновь сформировавшихся артериальных и венозных перетоков.
Применение подобной тактики позволило значительно улучшить результаты лечения больных портальной гипертензией, осложненной пищеводным кровотечением.
Совершенствование лечебных подходов при гнойно-деструктивных заболеваниях легких.
В лечение гнойно-деструктивных заболеваний легких (ГДЗЛ) нами разработана методика длительной трансбронхиальной катетеризации полости деструкции.
Больному первоначально выполнялась микротрахеостомия. После этого катетер под контролем фибробронхоскопии и рентгенологического контроля проводили в полость деструкции. В связи с тем, что конец катетера нередко смещается и выталкивается при кашлевых движениях из полости деструкции, мы конец катетеров смоделировали в виде петли. Катетер проводили в полость деструкции по проводнику-струне, после удаления которой конец катетера приобретал форму петли, препятствующий его дислокации.
Для адекватной санации гнойного очага в легком применяются методы трансторакального дренирования. Несмотря на положительные моменты трансторакального дренирования двухпросветными дренажами, они имеют ряд недостатков: невозможность постоянного проточного лаважа полости деструкции, так как основная часть жидкости при этом, минуя полость, сбрасывается в широкий просвет трубки; при фракционном лаваже жидкость с гнойным содержимым нередко забрасывается через дренирующий бронх в непораженные участки трахеобронхиального дерева, способствуя распространению патологического процесса; невозможность создать в полости деструкции из-за наличия дренирующего бронха разрежение, способствующее санации полости, ее спадению, расплавлению неповрежденных участков легкого; развитие грануляционной ткани в области устьев дренирующих бронхов ведет к нарушению их проходимости, дренажной функции, возникновению замкнутых полостей после удаления трансторакального дренажа, что в ряде случаев способствует рецидиву нагноительного процесса, длительному сохранению остаточных полостей в легочной ткани.
Учитывая эти недостатки нами предложена методика «двойного» дренирования плевральной полости, суть которого заключалась в следующем. Больному выполнялось трансторакальное дренирование и трансбронхиальная катетеризация полости деструкции с обтурацией устья дренируемого бронха для профилактики распространения процесса. Трансторакальный дренаж подключался к ативной аспирации, а путем введения антисептиков через трансбронхиальный катетер проводился непрерывный лаваж очага деструкции.
Одним из ключевых моментов воздействия на гнойно-воспалительный процесс в легочной ткани является необходимость создания в патологическом очаге продолжительной постоянной высокой концентрации лекарственных препаратов, действующих на различные факторы патогенеза. Использование для этой цели обычных путей введения лекарственных препаратов в большинстве случаев не позволяет добиться желаемого эффекта.
В результате проведенных исследований сформулированы показания к более широкому применению длительной регионарной инфузии лекарственных препаратов в бронхиальную артерию, воздействующих на различные факторы патогенеза гнойно-воспалительного процесса легочной ткани. Обоснована необходимость раннего ее включения в комплекс лечебных мероприятий при возникновении признаков гнойной деструкции легочной ткани. Разработан оптимальный состав инфузата для внутриартериального введения и рациональная схема регионарной инфузии («Способ лечения гнойно-воспалительных заболеваний легких» №4905601/14).
При ГДЗЛ наибольшую опасность представляет собой массивное легочное кровотечение, которое нередко ведет к острой асфиксии вследствие тотального заполнения кровью трахеобронхиального дерева и к летальному исходу. Результаты лечения данной группы больных во многом зависят от точности и быстроты определения локализации источника кровотечения, выяснения причины и степени поражения легких и выбора метода лечения.
Одним из ключевых моментов в лечении легочного кровотечения является эмболизация бронхиальной артерии. При эмболизации используем гемостатическую губку, спирали Гиантурко, мелко нарезанные нити кетгута, спиртово-глицериновую смесь.
Интенсивная консервативная терапия в сочетании с бронхологическими методами временной остановки кровотечений, острой эмболизацией бронхиальной артерии позволила в большинстве случаев добиться стойкой остановки кровотечения, провести в «холодном» периоде мероприятия, направленные на стабилизацию состояния больного, осуществить комплексное обследование и выполнить плановое оперативное вмешательство.
Совершенствование лечебных подходов при механической желтухе.
Хирургическое лечение механической желтухи сопровождается высоким уровнем послеоперационных осложнений и летальности, что во многом объясняется несоответствием между тяжестью оперативного вмешательства и компенсаторными функциональными возможностями печени, глубиной холемического поражения почек и других жизненно важных органов, пожилым и старческим возрастом, наличием сопутствующих заболеваний.
В этой связи в клинике применяется разработанная методика двухэтапного лечения, когда на первом этапе применяют мероприятия, направленные на ликвидацию явлений механической желтухи, печеночной недостаточности, коррекцию нарушенных основных функций органов и систем организма. После стабилизации состояния больных вторым этапом устраняется причина механической желтухи, восстанавливали нормальный пассаж желчи в кишечник.
В качестве декомпрессивных мероприятий первого этапа в клинике дифференцированно применяются малоинвазивные вмешательства: эндоскопические или чрескожные чреспеченочные эндобилиарные процедуры. При подозрении на холедохолитиаз, невыраженной механической желтухе (общий билирубин 150 мкмоль/л и менее) предпочтение отдается дозированной порционной эндоскопической папиллосфинктеротомии.
Чреспеченочные вмешательства применяются при тяжелых степенях механической желтухи, наличии признаков холангита, при отсутствии эффекта или противопоказаниях к эндоскопическому лечению. Набор патологий при этом сводится в основном к стриктурам воспалительного, ятрогенного, опухолевого генеза, крупным конкрементам холедоха с механической желтухой, острым деструктивным формам обтурационного холецистита при наличии значительного риска оперативного вмешательства.
Разработанные на кафедре способы пункции, катетеризации, проведения длительного дренирования, дозированной декомпрессии и санации позволяют существенно повысить эффективность чреспеченочных методов лечения механической желтухи, снизить вероятность развития осложнений.
Показанием перехода к окончательному этапу лечения ЖКБ, восстановления стойкого пассажа желчи в кишечник считаем: общее удовлетворительное состояние организма, снижение уровня билирубина крови до 50 мкмоль/л и ниже, трансаминаз до 1,5-1 мкмоль/л и ниже, нормализация других основных лабораторных тестов, снижение концентрации бактериальной флоры до 10³-10⁴ микробных тел/мл. По нашим данным такое состояние наступает при легкой степени ПН на 7-8 сутки, средней – на 10-12 сутки, тяжелой – на 15-17 сутки.
Кроме хирургических методов восстановления адекватного оттока желчи в кишечник в клинике по показаниям активно используются малоивазивные технологии, такие как литэкстракция желчных камней эндоскопическим, чреспеченочным доступом, либо их сочетанием, эндобилиарная дилатация стриктур желчных протоков и билиодигестивных анастомозов, эндопротезирование желчных протоков.
Чрескожные эндобилиарные вмешательства при механической желтухе злокачественного генеза.
В зависимости от блока ЖВП предложены различные подходы к выполнению эндобилиарных вмешательств.
При поражении дистального отдела холедоха при периампулярных опухолях сохраняются наиболее удобные условия для наложения холангиостомы. При этом большая дистанция дренируемого участка над блоком при катетеризации холедоха обеспечивает стабильное положение дренажа, препятствующее его миграции. Небольшая протяженность опухолевой стриктуры позволяет в большинстве случаев произвести реканализацию блокированного участка и установить широкий дренаж в кишечник для внутреннего оттока желчи.

Необходимо отметить, что внутренний диаметр дренажа в данном случае должен быть не менее 3 мм. В противном случае, адекватного оттока желчи в кишечник добить не удасться. У больных с паллиативным характером проводимого лечения замена дренажа проводится обычно через 2-3 месяца.
Опухолевое поражение средней части холедоха значительно затрудняет внутреннюю фиксацию дренажа, что является одной из основных причин его миграции и выпадения. В этой связи считаем весьма важным использование в этой ситуации катетеров типа «Pig tail» или установку дренажа в виде петли для профилактики осложнений. При безуспешности реканализации стриктуры для безопасного и эффективного дренирования необходимо проведение катетера через зону слияния долевых протоков в левую долю печени, увеличивая тем самым дренируемую дистанцию и фиксацию дренажа. У подавляющего большинства пациентов удается выполнить реканализацию блока и дренирование дистальной части холедоха. Весьма важным моментом является сохранение запирательной функции сфинктера Одди для профилактики холангита.
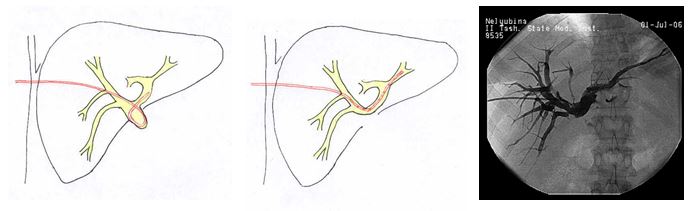

При блоках желчевыводящей системы, соответствующим типу IV по классификации Bismuth H. при разобщении желчевыводящей системы для создания условий оптимального дренирования необходима раздельная катетеризации протоковой системы правой и левой долей. С целью профилактики холангита в одной из блокированных долей вмешательство следует проводить либо одномоментно, либо с интервалом не более 1-2 суток. Если удавалось выполнить реканализацию, то последовательная замена дренажей с увеличением диаметра позволяла затем соединить наружные концы дренажных трубок, обеспечивая тем самым внутренний отток желчи через замкнутую систему дренажей. Запирательная функция сфинктера Одди при этом также сохранялась.
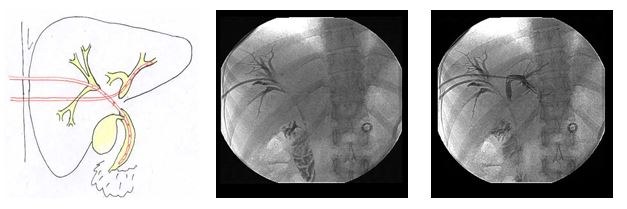
При неудачах реканализации стриктур проводили раздельное дренирование правой и левой долей печени. При этом для адекватного оттока желчи путем создания протяженного дренируемого участка, а также профилактики миграции дренажа катетер вводился анте- или ретроградно: пункцией парамедианной ветви с заведением в дорзолатеральный сектор, и наоборот.
Таким образом, эффективность применения малоинвазивных декомпрессивных вмешательств в лечении механической желтухи опухолевого генеза определяется дифференцированным выбором метода дренирования. Выделенные нами виды декомпрессии в зависимости от характера поражения желчных протоков наиболее типичны и позволяют выбрать необходимый и безопасный способ дренирования. Вместе с тем, конечно они не могут в полной мере охватить все клинические ситуации.
Совершенствование лечебных подходов при критической ишемии нижних конечностей.
Совершенствованием лечебных подходов при критической ишемии наша кафедра занимается на протяжении более 20 лет после внедрения в клиническую практику эндоваскулярных вмешательств.
Первые разработки связаны с применением длительной внутриартериальной катетерной терапии (ДВАКТ) в лечении критической ишемии нижних конечностей (КИНК). У больных с гангреной нижних конечностей оперативные вмешательства выполняли через несколько суток после проведения ДВАКТ. Показанием к реконструктивным или паллиативным вмешательствам является наличие положительной динамики показателей регионарной гемодинамики в течение 3-4 суток ДВАКТ. При этом во всех случаях ЛПИ должен быть выше 0,4. При отсутствии клинического эффекта в течение 3-4 суток проведения ДВАКТ и сохранения ЛПИ на уровне ниже критической величины (< 0,4) целесообразно выполнение первичной ампутации конечности больным с гангреной нижних конечностей. У пациентов с КИНК, которым по тем или иным причинам невозможно произвести реконструктивную операцию, была доказана эффективность сочетанного применения ДВАКТ с чрескожной электронейростимуляцией.
Проведенные исследования показали, что эффективность оперативного вмешательства при КИНК находится в прямой корреляционной зависимости от уровня функциональных резервов микрососудов пораженной конечности. Снижение ТсPO2 до 0 мм рт.ст. на постуральной пробе, отсутствии повышения ТсPO2 на ортостатической пробе и увеличении времени начала прироста ТсPO2 более 230 сек. при проведении пробы на реактивную гиперемию, свидетельствовало о неэффективности проведения ДВАКТ. Этим больных было показано выполнение экстренной ампутации пораженной конечности.
Ряд новых подходов в лечении КИНК связаны с проведеним эндоваскулярной дилатации стенозированных участков артерий нижних конечностей. Нами были предложено выполнение «гибридных» операций. Пациентам с КИНК на первом этапе выполняли интераоперационную дилатацию подвздошных артерий с последующим проведением малых реконструкций бедренно-подколенного сегмента и устанавлением в бедренную артерию катетера для проведения ДВАКТ в послеоперационном периоде.

При одной лишь функционирующей берцовой артерии до проведения рентгенэндоваскулярной дилатации подколенной артерии проводили ДВАКТ, тем самым подготавливали периферическое артериальное русло к притоку крови, возникающему после РЭД, которая способствовала профилактике тромбозов, связанных с микроэмболией и спазмом артерий при дилатации протяженных обструкций.
Разработка эндоваскулярных вмешательств при надпочечниковой гипертензии.
На сегодняшний день бесспорным является тот факт, что в развитии артериальной гипертензии и переходе ее в тяжелое течение ведущее значение имеет активация ренин-ангиотензин альдостероновой системы, который обусловлен гиперфункцией коры надпочечников. Удаляя надпочечник или подавляя гиперфункцию коры надпочечников, можно добиться улучшения течения АГ или, даже, нормализации АД. Учитывая этот факт в нашей клинике (1989) разработан метод рентгеноэндоваскулярной деструкции надпочечника путем эмболизации венозного русла надпочечника 3% раствором тромбовара. Больному выполняется надпочечниковая флебография После введения седативных и обезболивающих средств в надпочечниковую вену через катетер быстро вводится 3% раствор тромбовара, который вызывает его острую окклюзию.
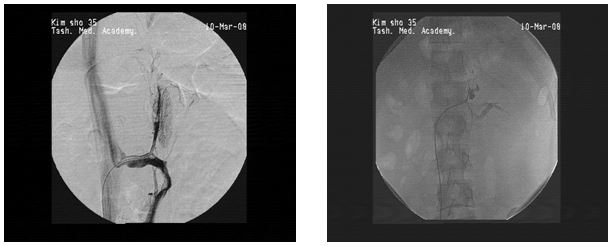
Метод острой окклюзии тромбоваром является эффективным вмешательством, однако имеет свои недостатки, в частности, не происходит тромбоза самого ствола центральной вены при окклюзии внутриорганного венозного русла. Это может привести к реканализации вен и рецидиву гипертензии. Другими недостатками метода острой окклюзии являются выраженные колебания АД вовремя процедуры, что требует проведения адекватной коррегирующей терапии.
Этого недостатка в определенной степени лишен метод электрокоагуляции центральной вены надпочечника. Если методика острой окклюзии тромбоваром преследует цель рентгенэндоваскулярной деструкции надпочечника и уменьшение источника секреции кортикостероидных гормонов, то целью метода электрокоагуляции является достижение непрямой портализации надпочечниковой венозной крови и инактивация кортикостероидов в печени (Мазо Е.Б.,1990). Однако данная методика неэффективна у тех больных, у которых на флебограммах имеются коллатеральные перетоки от надпочечника в системы верхней и нижней полых вен через вены капсулы почки, через нижнюю диафрагмальную вену, через притоки почечной вены, вены позвоночного сплетения и т.д. Учитывая данный факт, нами разработан другой способ подавления гиперфункции надпочечника — острая окклюзия венозного русла надпочечника в сочетании с электрокоагуляцией центральной вены надпочечника.
Техника проведения данной методики: после выполнения флебографии и оценки состояния ангиоархитектоники надпочечника через катетер, введенный в ствол центральной вены, вводится 5 мл 3% раствора тромбовара, выполняется контрольная флебография и после подтверждения окклюзии поверхностной венозной сети надпочечника вместе с коллатералями и внутриорганного венозного русла, Г — образным рентгенконтрастным проводником максимально вклиненным в ствол центральной вены надпочечника выполняется электрокоагуляция ее просвета от периферии к центру 4 — 5 кратно с экспозицией по 2-3 секунды. Контрольная флебография. После выявления тотальной окклюзии венозного русла надпочечника, катетер удаляется.

Совершенствование лечебных мероприятий при остром холецистите
Одним из основных методов лечения калькулезного холецистита является лапароскопическая холецистэктомия. Однако при остром воспалении и обтурации желчного пузыря возникают определенные сложности в идентификации элементов треугольника Кало. Учитывая данный факт нами разработан способ лапароскопической холецистэктомии.
Кроме острого холецистита, данная методика применима при развитом жировом, рубцово-склеротическом процессе. Предложенная методика включает в себе элементы выполнения холецистэктомии «от дна» и «от шейки» (Изобретение IHDP. 7900592.1/DF от 26.02.99). Техника выполнения заключается в следующем: дно пузыря захватывается жестким зажимом и, по возможности, заводится под диафрагму и вправо. Тупым и острым путем проводится выделение тела пузыря из сращений. Все манипуляции выполняются эндодиссектором максимально близко к стенке желчного пузыря. После коагуляции, окружающие ткани как бы «стаскиваются» со стенки пузыря вниз и в сторону. В области шейки на 1 — 1,5 см выше ее на передней стенке в поперечном направлении крючком перфорируют стенку желчного пузыря. В отверстие вводят наконечник аквапуратора, с потоком жидкости аспирируют песок и мелкие камни (рис. а). Отверстие в пузыре расширяют до 1,5 – 2 см эндокрючком под электрокоагуляцией в поперечном направлении. При этом дно пузыря, захваченное зажимом, больше запрокидывается под диафрагму. Вторым зажимом фиксируют проксимальный край рассеченной стенки желчного пузыря. В брюшную полость вводят контейнер, в который перемещают конкременты из полости желчного пузыря. Контейнер временно помещают в правой половине брюшной полости. В области печеночно-пузырного перехода с обеих сторон в продольном направлении, Т-образно, по отношению к разрезу в стенке тела желчного пузыря, эндокрючком производят рассечение серозной оболочки пузыря на протяжении 1,5 — 2 см. (рис. б).

Подтягивая зажимом, захваченный за проксимальный край рассеченного участка пузыря, диссектором с обеих сторон отделяют заднюю стенку пузыря от ложа, с одновременным его пересечением под коагуляцией. При этом происходит пересечение либо ствола, либо ветвей пузырной артерии, что при недостаточной коагуляции может привести к значительному кровотечению, которое способна остановить дополнительная коагуляция. В дальнейшем, дистальная половина желчного пузыря, захваченная зажимом, используется для отведения печени и создания условий для проведения операции (рис. в).
Зажим на проксимальной части переносят с передней на заднюю стенку. Диссектором выделяют проксимальную часть пузыря по направлению к шейке. Препаровка элементов шейки желчного пузыря осуществляется сзади, что обычно не вызывает каких-либо трудностей. Первым этапом выделяется, клиппируется, пересекается пузырная артерия. Далее проксимальная часть пузыря представляет из себя воронку, основанием которой является пузырный проток, легко дифференцируемый как снаружи, так и изнутри пузыря. Окружающие ткани пузырного протока тупым путем смещают по направлению к холедоху. На пузырный проток накладывают две клипсы, он пересекается и проксимальная часть пузыря удаляется (рис. г).
Дистальную половину пузыря отделяют от ложа традиционным путем. Осуществляется коагуляция ложа пузыря. Троакар размером 10 мм в эпигастрии заменяется на 20 мм, через который производят удаление из брюшной полости фрагментов желчного пузыря и контейнера с конкрементами.
Совершенствования торакоскопических вмешательств при эхинококкозе легких.
На кафедре факультетской и госпитальной хирургии впервые в мире разработана и внедрена в клиническую практику торакоскопическая и видеоторакоскопическая эхинококкэктомия легкого.
Торакоскопическая эхинококкэктомия.
Показания: небольшие, до 4 см в диаметре, неосложненные, периферически расположенные кисты.
Техника выполнения: Учитывая нестандартность локализации кист в легочной ткани, точки наложения пневмоторакса и введения троакаров выбирали в каждом случае индивидуально. При этом предпочтение отдавали точкам, расположенным в VII — VIII межреберьях по задней подмышечной линии, III межреберье по передней подмышечной линии, учитывая использование этих проколов для дренирования плевральной полости по завершении оперативного вмешательства, а также точки, расположенные по ходу V или VI межреберья, учитывая, в случае необходимости, возможность перехода к торакотомии. Накладывали пневмоторакс, и первый троакар (10 мм) для оптики вводили в точке, максимально удаленной от зоны локализации кисты.
После определения точной локализации кисты, прямо над ней производили разрез кожи до 1,5 см и в плевральную полость под контролем зрения вводили специально разработанный «троакар — присоску» (А.С.№ IHDP 9900002.1 — Устройство для пункции), конец которого вплотную подводили к стенке кисты.
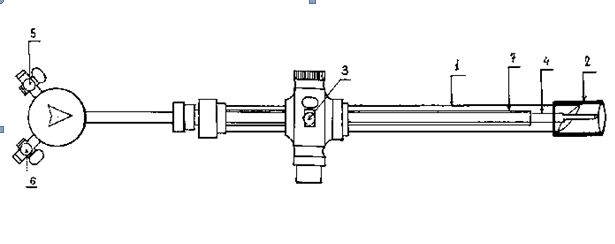
Устройство для пункции содержит наружную трубку (1), на рабочем конце которой установлена резиновая (силиконовая) манжета (2) и краник (3) для отсоса, внутреннюю трубку – переходник (7), расположенную соосно герметично наружной трубке, в которой размещена металлическая игла (4) с двумя краниками (5) и (6) для отсоса и ввода жидкости соответственно.
Устройство работает следующим образом: металлическую иглу вводят во внутреннюю трубку-переходник, который затем размещают в наружной трубке с резиновой (силиконовой) манжетой на кончике трубки. К кранику подключают вакуумный аспиратор (отсос) для создания вакуума в просвете трубки, а к кранику подключают второй отсос для эвакуации жидкости из полости эхинококковой кисты. Манжетку плотно прижимают к стенке кисты, создается изолированная зона для пункции кисты. Легким движением вперед производят пункцию кисты иглой, при этом жидкость из просвета кисты аспирируется через иглу в эвакуатор, в случае затекания эхинококковой жидкости вокруг иглы она аспирируется через просвет трубки. После полного опорожнения эхинококковой кисты краник для отсоса закрывают, и через краник для ввода жидкости в полость кисты вводят 100% глицерин с целью достижения апаразитарности эхинококковой кисты, после этого извлекают иглу из кисты, затем удаляют трубку с манжетой, отключив разрежение. «Троакар-присоска» отсоединялась от стенки кисты. Фиброзная оболочка кисты фиксировалась эндозажимом, полость кисты вскрывалась электроножом. Хитиновая оболочка удалялась либо через 10 мм трубку мощной вакуум-аспирацией, либо эндоскопическим зажимом. Свободные участки фиброзной оболочки иссекались эндоножницами под электрокоагуляцией. Внутренняя поверхность кисты также дополнительно коагулировалась. Полость кисты заполнялась жидкостью и путем раздувания легкого осуществлялся поиск бронхиальных свищей, последние ликвидировались электрокоагуляцией или наложением эндошвов.
Видеоторакоскопическая эхинококкэктомия легкого (или операции с применением «видеоассист» — техники).
Показания: размеры кисты более 4 см в диаметре; центральное расположение эхинококковых кист; осложненные кисты (нагноившиеся кисты, прорвавшиеся в бронхиальное дерево или в плевральную полость).
Техника выполнения: Учитывая размеры эхинококковой кисты, оперативное вмешательство (доступ к объекту) начинали двумя методами:
- При кистах размерами от 4 до 8 см в диаметре оперативное вмешательство начинали с наложения пневмоторакса. Введение иглы Вереса осуществлялось в VII-VIII межреберье по задней подмышечной линии — при локализации кисты в передне-верхних отделах легкого и в III межреберье по передней подмышечной линии — при локализации кисты в задненижних отделах легкого. После наложения пневмоторакса в этой же точке в плевральную полость вводили 10 мм троакар и оптику. Осуществляли ревизию плевральной полости. Поиск кисты осуществляли по вышеприведенным признакам. После установления точной локализации кисты, над ее проекцией выполняли миниторакотомию — 3-5 см. Миниторакотомии выполнялись, в зависимости от локализации кисты, в IV-VII межреберьях в зоне, лежащей между задней и передней подмышечной линиями. При этом максимально старались избегать пересечения мышц (мышечные волокна раздвигались послойно, кроме межреберных мышц).
- При кистах размерами более 8 см в диаметре, а также при возникновении трудностей наложения пневмоторакса, связанных со спаечным процессом в плевральной полости, оперативное вмешательство начинали с выполнения миниторакотомии, ориентиры для выполнения которой заранее намечали во всех наблюдениях согласно данным рентгенологического обследования. Через рану в плевральную полость вводили «троакар-присоску», подключенную к электроотсосу и опорожняли кисту по вышеописанному способу. В последующем через миниторакотомную рану выполнялась стандартная эхинококкэктомия.
Одним из трудных моментов в выполнении торакоскопической и видеоторакоскопической эхинококкэктомии является ликвидация остаточной полости, особенно при глубоких остаточных полостях.
Нами разработан новый способ капитонажа эхинококковой полости при выполнении видеоторакоскопической эхинококкэктомии легких (авторское свидетельство IAD №20055105).
Для этого при глубоких остаточных полостях по заявляемому способу производят захват центральной части дна остаточной эхинококковой полости накладыванием шва. Один конец этой нити является осевым, другим концом накладывают спиралеобразный шов. Начиная с захваченного участка центральной части дна остаточной полости, спиралью по часовой стрелке накладывают шов, захватывая стенки остаточной эхинококковой полости. При этом после полного завершения витка спирали, и в дальнейшем после каждого витка, производится завязывание шва с осевым концом нити, не участвующим в создании витка спирали. Затем выполняют следующий оборот спирали, при этом шаг каждого из витка спирали должен быть как можно минимальным, не превышать 2 см. Одним из определяющих моментов применения этого метода капитонажа является ее выполнение вокруг одной оси, что немаловажно при выполнении ВТЭЭ легких.
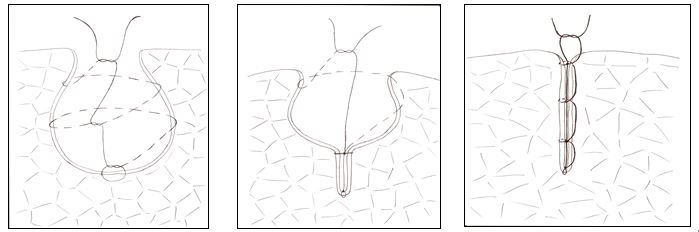
Для оценки эффективности предлагаемого нами способа были рассмотрены варианты применения различных видов швов с точки зрения силового воздействия шовной нити на материал ткани. Результаты проведенных исследований показали, что, при применении кисетного шва, вертикальной деформации тканей стенок полости не происходит, и сила стягивания становится равной силе натяжения шовной нити. При всех других видах швов действуют оба направления деформации, что позволяет обосновать целесообразность используемой нами методики ликвидации остаточной полости.
Совершенствование эндоваскулярных вмешательств при опухолях печени и поджелудочной железы.
Лечебный алгоритм при опухолях печени заключался в следующем. При операбельной опухоле проводилась химиоэмболизация печеночной артерии с целью уменьшения объема поражения.
При операбельной опухоли следующим этапом выполняется предоперационная эмболизация ветви воротной вены, питающей пораженную часть печени, что вызывает ее атрофию, но самое главное – гипертрофию контрлатеральной доли печени. Это является профилактикой возникновения послеоперационной печеночной недостаточности. После эмболизации ветвей воротной вены выполняется оперативное вмешательство.
Для химиоэмболизация печеночной артерии и вены использовали масляную эмульсию йодолипола с доксоpубицином или адpиобластином.
При неоперабельной опухоли тактика зависит от ангиографической картины – при гиперваскулярном образовании выполняли химиоэмболизацию печеночной артерии, а при гиповаскулярном образовании – химиоинфузию.
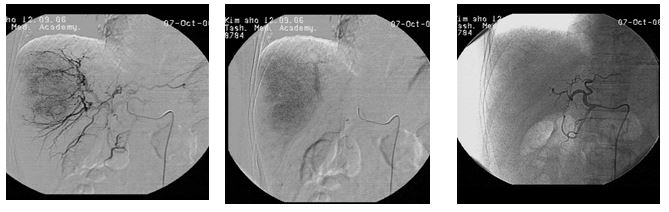
У пациентов с распространенным опухолевым процессом или множественными очагами вмешательство выполняли в два-три этапа с интервалом 3-4 недели, завершая последний этап эмболизацией артерии металлической спиралью. Внутриартериальное введение маслянной эмульсии антибластомных препаратов сопровождалось интенсивным накоплением ее в очагах, которое наблюдалось при рентгенологическом контроле до 1,5-9 мес. Неоднократное, с интервалом 21-28 дней, введение препарата позволяло добиться максимально полного заполнения объемного образования и дополнительных очагов. Последующая эмболизация ветвей печеночной артерии металлической спиралью приводила к резкому снижению кровоснабжения гиперваскуляризированных опухолей.
При опухолях поджелудочной железы выполняется эмболизация артерий поджелудочной железы.
Методика предложена академиком Грановым Д.А. Данный метод лечения иноперабельного рака поджелудочной железы, в нашей клиники, успешно применяется с 2004 г. Суть метода заключается в резком замедлении регионарного кровотока в опухоли в результате селективной эмболизации ее артерий смесью химиопрепарата гемзара в липойодоле. В дальнейшем введенный масляный эмболизат дезагрегируется по микроциркуляторному руслу, из которого происходит диффузия его непосредственно в ткани. Создается масляная химиоинфильтрация новообразования, что обеспечивает пролонгированный локальный контакт опухоли с высокой концентрацией введенного химиоэмболизата. Данный способ введения обеспечивает значительное повышение лечебного противоопухолевого эффекта без увеличения суммарной дозы химиопрепарата и токсической нагрузки на больного в целом.
Предложенная методика нами усовершенствована, предложена перераспределительная техника. После установки микрокатетера в гастродуоденальную артерию производят окклюзию дистальной части гастродуоденальной артерии спиралью. Лишь после этого вводят химиоэмболизат: суспензию гемцитабина 400-600 мг на 5 мл йодолипола. Затем окклюзировали питающую опухоль ГДА для предотвращения быстрого смывания препарата (Изобретение IAP 0093 от 20.03.07).


Хотелись бы отметить, что сфера научных интересов кафедры не ограничивается вышеуказанными проблемами. В разные годы на кафедре изучались и другие вопросы: проблемы эхинококкоза печени, вопросы профилактики и лечения раневой инфекции, проблемы экстракорпоральных методов детоксикации при различных патологических состояниях, вопросы совершенствования диагностики и лечения язвенной болезни и его осложнений и т.д. В настоящее время научные поиски продолжаются, а основным направлением является совершенствование и внедрение в клинику новых подходов в малоинвазивной хирургии.












